Le glaucome
Le glaucome est une maladie de l’œil associée à la destruction progressive du nerf optique, le plus souvent causée par une pression trop importante à l’intérieur de l’œil. Cette pathologie constitue la seconde cause de cécité dans les pays développés. A ce jour, des traitements permettent de stopper son évolution mais ils ne permettent pas de restaurer la vision lorsque la maladie est déjà évoluée. Le dépistage précoce du glaucome est donc primordial.
Comprendre le glaucome
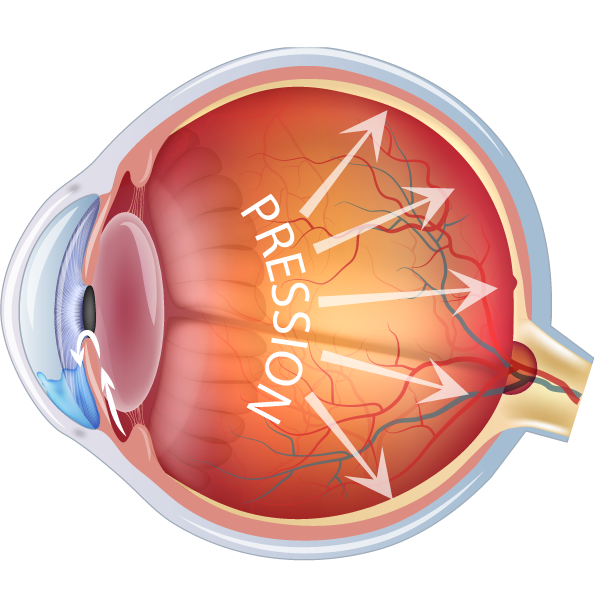
La pression oculaire en cause
Une maladie fréquente, notamment après 40 ans
Un dépistage indispensable
Quels sont les facteurs de risque ?
Une évolution plus ou moins rapide
La Dégénérescence Maculaire Liée à l’Âge (D.M.L.A.)
La dégénérescence maculaire liée à l’âge (D.M.L.A.) correspond à une dégradation d’une partie de la rétine (la macula), pouvant mener à la perte de la vision centrale. Cette maladie d’origine multifactorielle concerne les plus de 50 ans. Bien que très invalidante, la DMLA ne rend jamais totalement aveugle puisque la partie périphérique de la rétine reste intacte. Les chercheurs travaillent à l’amélioration de la prise en charge des différentes formes de DMLA.
Comprendre la dégénérescence maculaire liée à l’âge
Deux formes de DMLA
La macula en clair
Une perte de la vision centrale progressive
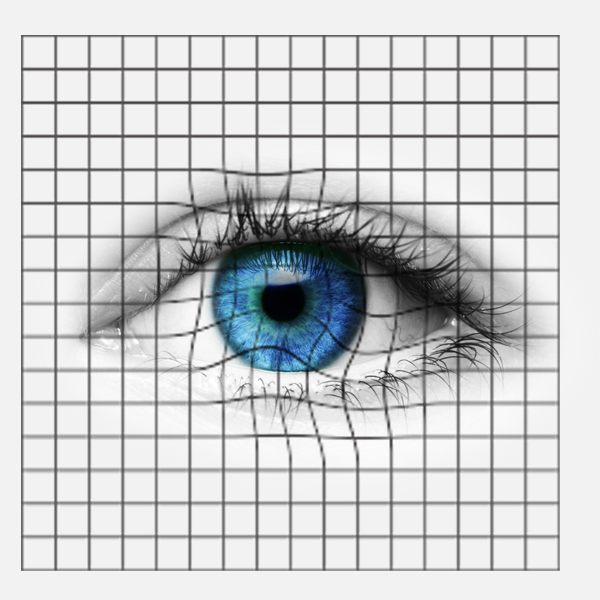
 Le test de la grille d’Amsler permet de détecter une DMLA. En tenant la grille d’Amsler au niveau de son œil, à une distance de lecture confortable, et en fixant le point central, les patients atteints voient des lignes déformées, interrompues ou brisées, parfois des zones floues ou aveugles. Il est dans ce cas urgent de contacter son médecin.
Le test de la grille d’Amsler permet de détecter une DMLA. En tenant la grille d’Amsler au niveau de son œil, à une distance de lecture confortable, et en fixant le point central, les patients atteints voient des lignes déformées, interrompues ou brisées, parfois des zones floues ou aveugles. Il est dans ce cas urgent de contacter son médecin.Une pathologie multifactorielle
Seule la forme humide se traite
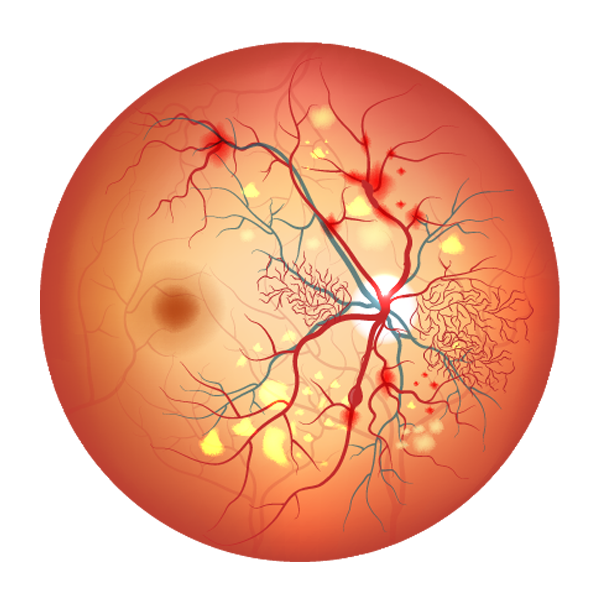
La rétinopathie diabètique
En vidéo : la rétinopathie diabétique et les complications des yeux expliquées par un spécialiste, plus d’autres vidéos sur les complications du diabète sur la chaîne YouTube officielle de la Fédération Française des Diabétiques.
Causes et processus de la rétinopathie diabétique
A l’extrémité des artères se trouvent les capillaires, ces petits vaisseaux qui irriguent les parties du corps et les organes. Composée de cellules visuelles et parcourue par une multitude de petits vaisseaux, la rétine est cette fine membrane de l’oeil qui réceptionne les impressions lumineuses venues de l’extérieur. Via le nerf optique, elle les transmet au cerveau qui les traduit en images. L’excès de sucre dans le sang fragilise la paroi des capillaires, entraînant une perte d’étanchéité. Il s’ensuit la rupture puis l’éclatement des vaisseaux rétiniens.
Rétinopathie diabétique et baisse de l’acuité visuelle
Au fur et à mesure, des zones étendues de la rétine ne sont plus oxygénées. En réaction, la rétine produit de nouveaux vaisseaux encore plus fragiles. Le phénomène s’amplifie et s’étend jusqu’à la macula (zone au milieu de la rétine) où se situe le centre de la vision. La macula s’épaissit, il se produit un œdème maculaire (gonflement de la macula), responsable alors d’une baisse de l’acuité visuelle qui peut être très importante et que partiellement réversible.
Par ailleurs, les néovaisseaux peuvent saigner en nappe dans le vitré devant la rétine, responsable d’une perte de la vision, jusqu’à résorbtion de l’hémorragie. Mais celle-ci peut ne pas se résorber et nécessiter donc une ablation chirurgicale (vitrectomie). Ces phénomènes peuvent conduire à l’apparition d’une fibrose qui peut entraîner une traction de la rétine avec risque de déchirure et donc de décollement de la rétine, responsable d’une perte définitive de la vision.
Complications du diabète au niveau des yeux : pas de symptômes au début…
Si certains troubles de la vue peuvent indiquer la présence d’une rétinopathie diabétique (lettres déformées à la lecture, difficultés à passer de la lumière à l’obscurité…) la maladie s’installe souvent sans donner de signes d’alerte. On peut donc être atteint de rétinopathie même avec une bonne vue et en l’absence de symptôme. D’où l’importance d’un contrôle régulier par un spécialiste et d’un dépistage précoce. Si on laisse s’étendre la maladie, celle-ci finira par toucher le centre de l’oeil et la rétine, créant de graves et irrémédiables troubles de la vision.
Par ailleurs, la rétinopathie accélère la survenue d’autres pathologies des yeux comme les glaucomes ou la cataracte.
Prévention et traitement de la rétinopathie du diabète
Si des traitements existent et sont efficaces (notamment au laser) pour freiner l’évolution de la maladie et empêcher la cécité, le meilleur traitement reste la prévention : par un contrôle régulier (au moins une fois par an) chez un ophtalmologue, l’atteinte de l’équilibre glycémique, une tension artérielle maîtrisée, ainsi qu’une bonne hygiène de vie.
Les examens de l’ophtalmologue
L’ophtalmologue procède à plusieurs examens comme :
- la mesure de l’acuité visuelle,
- la tension de l’oeil,
- voire la pratique une angiographie rétinienne (qui informe sur la perméabilité des vaisseaux rétiniens).
Mais le principal contrôle reste le classique “examen de fond d’oeil”, obtenu par dilatation de la pupille.
Contrôles par rétinographe
Plus récent et moins contraignant, le rétinographe non mydriatique permet une photographie numérique du fond d’oeil sans dilatation de la pupille. Précis, cet examen, d’une durée relativement courte, peut être réalisé par du personnel non médical (orthoptiste ou infirmier). Le recours plus général à cet appareil permettrait de repérer les nombreuses personnes qui ne sont pas dépistées.
La Fédération Française des Diabétiques défend l’usage et l’extension de cette technique, qui présente l’autre avantage d’être facilement transportable. Des expériences pilotes de dépistage itinérant ont déjà été réalisées dans ce sens sur le territoire, avec des résultats très positifs.